中3の11月の「定期テスト」の出題範囲になることが多い【塩化銅水溶液の電気分解】と【ダニエル電池】。
この2つにはどちらも「銅」が登場します。
【ダニエル電池】は2021年の教科書改訂で新しく習うようになりました。
2022年の公立高校入試では、14都府県で【ダニエル電池】に関する問題が出題されています!!!
(宮城・群馬・千葉・東京・神奈川・三重・京都・和歌山・鳥取・広島・愛媛・高知・福岡・長崎)
 保護者
保護者中学生の子どもが「銅は陽極?陰極?」と混乱しているみたい。
家でなんとかしたいな。
 プロ講師エリ
プロ講師エリお任せください!!!
この記事では、【覚えるべき化学式】、【塩化銅水溶液の電気分解】、【ダニエル電池】の3つに分けて重要事項の解説と問題作成をしています。
この記事を書いた人

この記事の結論
・銅は必ず「陽極」「陰極」という暗記はできない(状況によって陽極か陰極か変わる)。
・【塩化銅水溶液の電気分解】では、陽極で塩素が発生し、陰極に銅が付着する。
・【ダニエル電池】では、銅板が陽極、亜鉛板が陰極になる。(イオン化傾向が関係している)
記事内の問題は無料ダウンロードできます
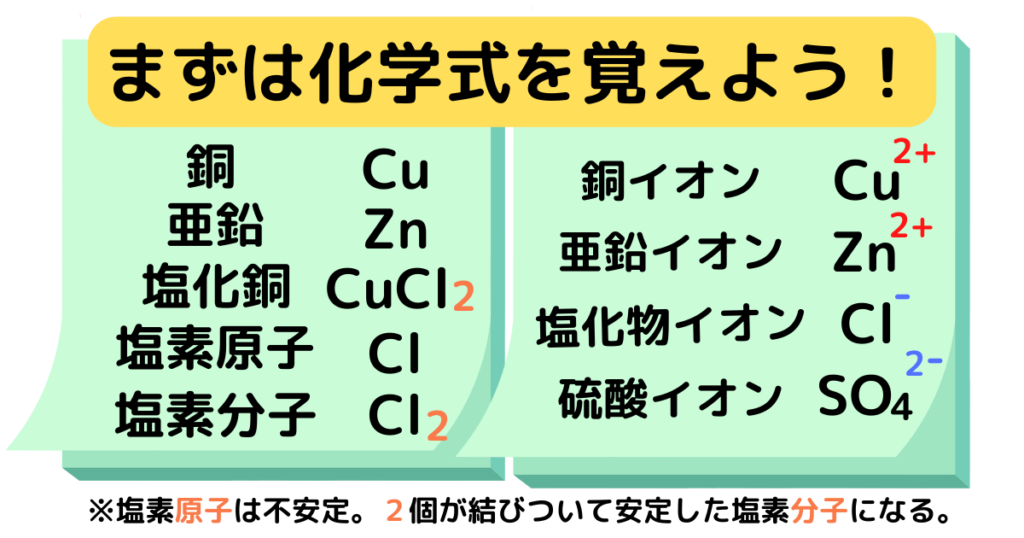
覚えるべき化学式はこの8つ!
 プロ講師エリ
プロ講師エリたくさんある化学式の中から、今回の記事で必要なものだけをまとめました!この8つを正確に覚えてから練習問題を解きましょう。
(中2内容)銅の元素記号はCu、銅の化学式もCu。
(中3内容)銅イオンCu2+は2価の陽イオンである。
(中2内容)亜鉛の元素記号はZn、亜鉛の化学式もZn。
(中3内容)亜鉛イオンZn2+は2価の陽イオンである。
(中2内容)塩素の元素記号はCl。塩素(分子)の化学式はCl2。
(中3内容)塩化物イオンCl–は1価の陰イオンである。
(中3内容)硫酸イオンSO42-は2価の陰イオンである。
練習問題0【化学式】
- 次の元素の元素記号を答えなさい。
(1)銅 (2)亜鉛 (3)塩素 - 次の物質の化学式を答えなさい。
(1)銅 (2)亜鉛 (3)塩素 - 次の化学式が表すイオンの名称をそれぞれ答えなさい。
(1)SO4$^2$$^-$ (2)Zn$^2$$^+$ (3)Cl$^-$ (4)Cu$^2$$^+$
答えはコチラ
- (1)Cu (2)Zn (3)Cl
- (1)Cu (2)Zn (3)Cl2
- (1)硫酸イオン (2)亜鉛イオン (3)塩化物イオン (4)銅イオン
 プロ講師エリ
プロ講師エリ塩素の元素記号は「Cl」ですが、塩素(分子)の化学式は「Cl2」です!
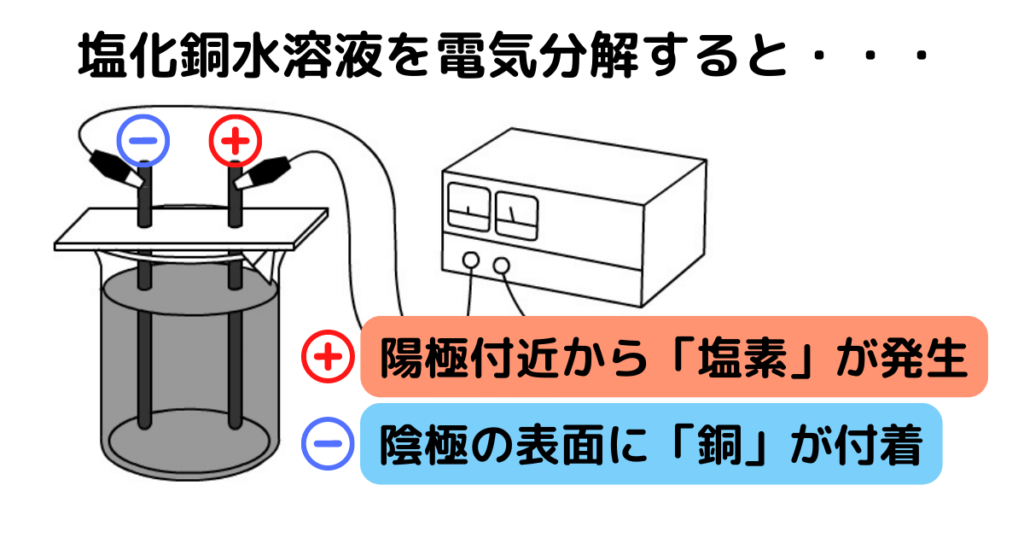
塩化銅水溶液の電気分解「陰極に銅が付着」
すぐに【塩化銅水溶液の電気分解】の練習問題が解きたい場合はコチラ
 プロ講師エリ
プロ講師エリ【塩化銅水溶液の電気分解】ではなぜ「銅」が陰極なのか、分かりやすく解説していきます!
(中2内容)塩化銅が銅と塩素に分かれる化学式は、下のように表されます。
・CuCl2 → Cu + Cl2
(中3内容)塩化銅は水に溶けると(水溶液にすると)、銅イオンと塩化物イオンに分かれます。
このことを電離を表す式にすると、下のように表されます。
・CuCl2 → Cu$^2$$^+$ + 2Cl$^-$
 プロ講師エリ
プロ講師エリイオンの移動は、磁石と同じように考えましょう。
磁石のN極がS極、S極がN極に引きつけられるのと同じで、
陽イオン(+)は-極(陰極)に、陰イオン(-)は+極(陽極)に向かって移動します!
銅イオンは陰極から電子を2個受け取って銅原子になります。
・Cu$^2$$^+$ + 2e$^-$ → Cu
塩化物イオンは陽極に電子を1個与えて、塩素原子になります。
・Cl$^-$ → Cl + e$^-$
塩素原子(Cl)は不安定なので、2個結びついて塩素分子(Cl2)になります。
テスト出題ポイント1
- 陰極に付着した赤い物質は?⇒銅。
陽極に発生した気体は?⇒塩素。 - 陰極に付着した物質の化学式は?⇒Cu。
陽極に発生した気体の化学式は?⇒Cl2。 - 塩化銅のように,水に溶かしたとき電流が流れる物質を何という?⇒電解質。
- 塩化銅水溶液に電流を流していると,しだいに水溶液の青色が薄くなった。なぜ?
⇒水溶液中の銅イオンの数が減少したから。
(別解)色のもとである銅イオンが減ったから。 - 水溶液中で,塩化銅が電離しているようすを化学式を使って表すと?
・CuCl2 → Cu$^2$$^+$ + 2Cl$^-$
 プロ講師エリ
プロ講師エリ見て覚えるだけでなく、問題を解きながら確認していきましょう!
練習問題1【塩化銅水溶液】
下の図のように,塩化銅水溶液に電流を流した。
- 塩化銅のように,水に溶かしたとき電流が流れる物質のことを何というか。
- 塩化銅が水に溶け,陽イオンと陰イオンに分かれているようすを, 電離を表す式で表しなさい。
- この実験で金属が付着した電極は陽極,陰極のどちらか。また,その金属の色は何色か。
- この実験で発生した気体の化学式を書きなさい。
- 塩化銅水溶液に電流を流し続けると,しだいに水溶液の青色が薄くなった。その理由を説明しなさい。
答えはコチラ
- 電解質
- CuCl2 → Cu$^2$$^+$ + 2Cl$^-$
- 陰極,赤色
- Cl2
- 水溶液中の銅イオンの数が減少したから。
(別解)色のもとである銅イオンが減ったから。
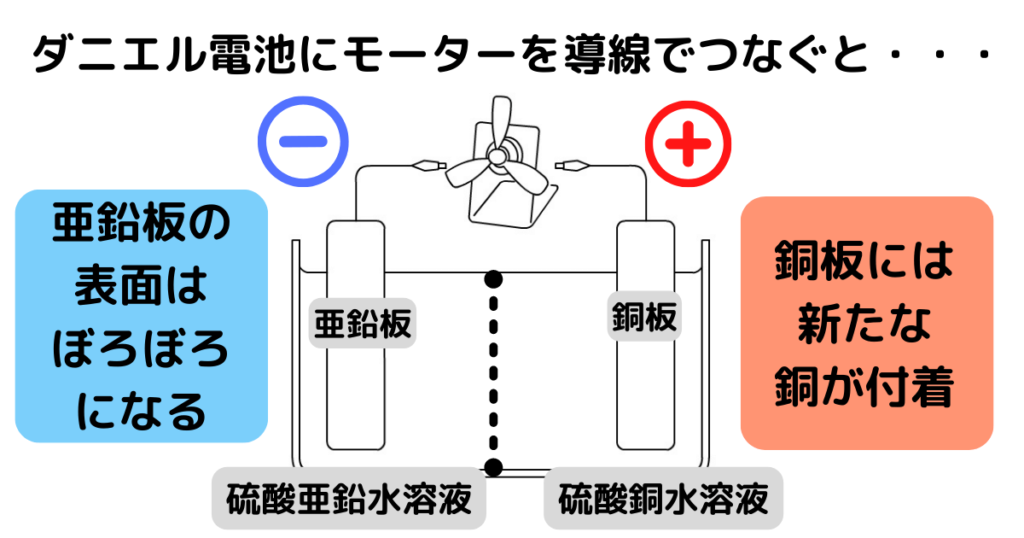
ダニエル電池「銅は陽極になる」
すぐに【ダニエル電池】の練習問題が解きたい場合はコチラ
【塩化銅水溶液の電気分解】は外から電流を流しますが、
今回の【ダニエル電池】は外からの電流ではなく、2種類の金属板と電解質水溶液を用いると電気エネルギーが取り出せるというものです。
 プロ講師エリ
プロ講師エリ【ダニエル電池】ではなぜ「銅」が陽極なのか、分かりやすく解説していきます!
硫酸亜鉛,硫酸銅は水に溶けると(水溶液にすると)、それぞれ陽イオンと陰イオンに分かれます。
このことを電離を表す式にすると、下のように表されます。
・ZnSO4 → Zn$^2$$^+$ + SO4$^2$$^-$
・CuSO4 → Cu$^2$$^+$ + SO4$^2$$^-$
亜鉛板の亜鉛(原子)は電子を2個失って、亜鉛イオンになります。
(亜鉛板はぼろぼろになっていく)
・Zn → Zn$^2$$^+$ + 2e$^-$
電子は導線を通って銅板に移動します。
(中2内容)電子の流れと電流は反対なので、電流は銅板から亜鉛板に流れることが分かります。
つまり銅板が陽極、亜鉛板が陰極となります。
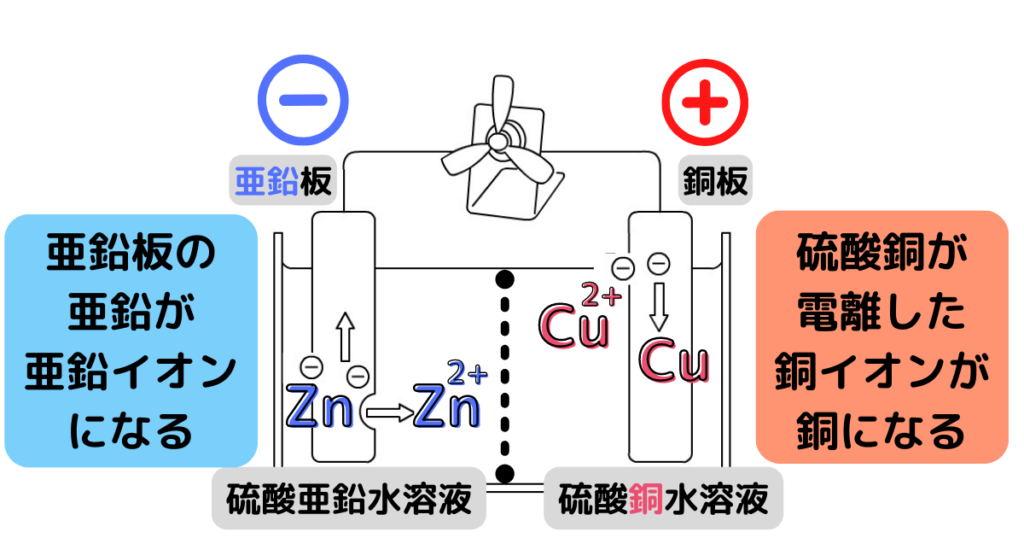
硫酸銅水溶液中の銅イオンは陽極から電子を2個受け取って銅原子になります。
(銅板には新しい銅が付着していく)
・Cu$^2$$^+$ + 2e$^-$ → Cu
 プロ講師エリ
プロ講師エリ亜鉛と銅のうち、なぜ「亜鉛」がイオンになるかは、次の「イオン化傾向」で説明します。
すぐに【ダニエル電池】の練習問題が解きたい場合はコチラ
イオン化傾向とは
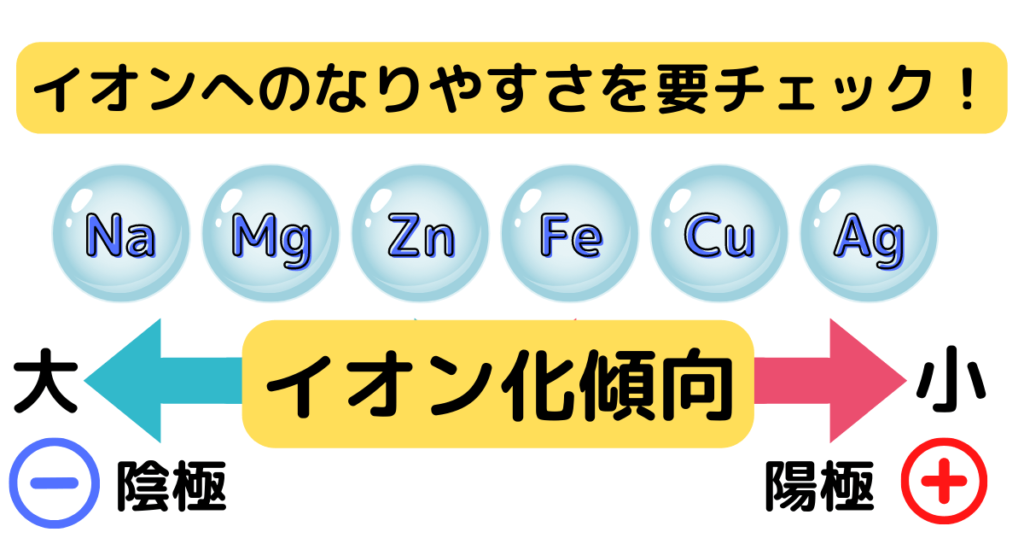
イオン化傾向とは、水溶液の中で陽イオンになりやすい順番を表したものです。
左側にあるほどイオン化傾向が大きく、他の物質と反応しやすいです。
 プロ講師エリ
プロ講師エリ亜鉛(Zn)と銅(Cu)を比べると、亜鉛の方が左側にあります。
つまり、亜鉛の方が陽イオンになりやすいことが分かります!

テスト出題ポイント2
下の図のように,ダニエル電池をつくった。
- 亜鉛板と銅板のうち,陽極になるのは?⇒銅板。
亜鉛と銅のうち,よりイオンになりやすいのは?⇒亜鉛板。 - 亜鉛板で起こる変化は?⇒亜鉛板の表面がぼろぼろになる。
銅板で起こる変化は?⇒銅板に新たな銅が付着する。 - 亜鉛が亜鉛イオンになるようすを化学反応式で表すと?
・Zn → Zn$^2$$^+$ + 2e$^-$ - 銅板で起こっている変化を化学反応式で表すと?
・Cu$^2$$^+$ + 2e$^-$ → Cu - もともと物質がもっているエネルギーを何という?
⇒化学エネルギー - 物質がもっているエネルギーを電気エネルギーに変換して取り出す装置を何というか。
⇒化学電池(電池) - 電子は,導線中を何極から何極に向かって移動する?
⇒陰極(-極)から陽極(+極)
練習問題2【ダニエル電池】
下の図のように,ダニエル電池をつくり,プロペラつきモーターをつないでしばらく回転させた。

- 陽極になるのは亜鉛板,銅板のどちらか。
- 電子の移動する向きは,亜鉛板から銅板,または銅板から亜鉛板のどちらか。
- プロペラが回転しているとき,亜鉛板の表面で起こっている化学変化を化学反応式で表しなさい。
- しばらくプロペラを回転させたとき,銅板の表面に付着する物質は何か。
- 電池の内部で電気エネルギーに変換される,物質がもつエネルギーを何エネルギーというか。
答えはコチラ
- 銅板
- 亜鉛板から銅板
- Zn → Zn$^2$$^+$ + 2e$^-$
- 銅
- 化学エネルギー
 プロ講師エリ
プロ講師エリ【ダニエル電池】を理解できているか、もう1パターン問題を解いて確かめてみましょう!
練習問題3【ダニエル電池】
下の図のように,ダニエル電池をつくり,プロペラつきモーターをつないでしばらく回転させた。

- 回路を流れる電流について正しいものをア~エの中から選びなさい。
ア. +極である亜鉛板から,導線を通って-極である銅板に流れた。
イ. +極である銅板から,導線を通って-極である亜鉛板に流れた。
ウ. -極である亜鉛板から,導線を通って+極である銅板に流れた。
エ. -極である銅板から,導線を通って+極である亜鉛板に流れた。 - しばらくプロペラを回転させると,銅板に銅が付着した。この理由について正しいものをア~エの中から選びなさい。
ア. 硫酸銅水溶液の中の銅イオンが,電子を失って銅になったから。
イ. 硫酸銅水溶液の中の銅イオンが,電子を受け取って銅になったから。
ウ. 銅板が,電子を失って銅イオンになったから。
エ. 銅板が,電子を受け取って銅イオンになったから。 - しばらくプロペラを回転させると,亜鉛板はぼろぼろになった。ア,イのうち,亜鉛板で起こっていた化学変化として正しい方はどちらか。
ア. 亜鉛原子が電子を失い,亜鉛イオンになった。
イ. 亜鉛原子が電子を受け取り,亜鉛イオンになった。 - 物質がもっているエネルギーを電気エネルギーにして取り出す装置を何というか。
答えはコチラ
- イ
- イ
・Cu$^2$$^+$ + 2e$^-$ → Cu - ア
・Zn → Zn$^2$$^+$ + 2e$^-$ - 化学電池(電池)
「銅は陽極?陰極?」【塩化銅水溶液】と【ダニエル電池】まとめ
この記事では、【覚えるべき化学式】、【塩化銅水溶液の電気分解】、【ダニエル電池】の3つに分けて重要事項の解説と問題作成をしています。
記事内の問題は無料ダウンロードできます
 プロ講師エリ
プロ講師エリ【ダニエル電池】は2021年度の教科書改訂で新しく追加されました。定期テストでも公立高校入試でも、さらに出題が増えていくことが予想されます!
この記事の結論
・銅は必ず「陽極」「陰極」という暗記はできない(状況によって陽極か陰極か変わる)。
・【塩化銅水溶液の電気分解】では、陽極で塩素が発生し、陰極に銅が付着する。
(理由)
塩化銅は水に溶けると(水溶液にすると)、銅イオンと塩化物イオンに分かれる。
・CuCl2 → Cu$^2$$^+$ + 2Cl$^-$
陽イオンであるCu$^2$$^+$は陰極に、陰イオンであるCl$^-$は陽極に向かって移動する。
・【ダニエル電池】では、銅板が陽極、亜鉛板が陰極になる。
(理由)
亜鉛は銅よりも陽イオンになりやすい(イオン化傾向)。
・Zn → Zn$^2$$^+$ + 2e$^-$
電子は導線を通って銅板に移動する。
電子の流れと電流は反対なので、電流は銅板から亜鉛板に流れる。




コメント